Die wachsende Bedeutung immunregulatorischer Effekte von körperlicher Aktivität
Editorial der Ausgabe #12/2017 der Deutschen Zeitschrift für Sportmedizin und Prävention (DZSM) von Prof. Karsten Krüger. Der Wissenschaftler arbeitet schwerpunktmäßig an molekularen und zellulären Grundlagen trainingsinduzierter Anpassungen und Mechanismen anti-entzündlicher Effekte von Sport. In seinem Beitrag beleuchtet er die Rolle chronisch-subklinischer Entzündungen in der Pathogenese zahlreicher innerer, orthopädischer, neurologischer und psychischer Erkrankungen.
Die Evidenzen für eine bedeutende Rolle chronisch-subklinischer Entzündungen in der Pathogenese zahlreicher innerer, orthopädischer, neurologischer und psychischer Erkrankungen verdichten sich stetig. Betrachtete man systemisch-entzündliche Veränderungen noch vor einigen Jahren als Epiphänomen oder Symptom vieler Erkrankungen, hat sich nun der Fokus verstärkt auf immunologische Ursachen entsprechender pathophysiologischer Prozesse gerichtet. Ein Beispiel hierfür ist der Diabetes Typ II, bei dem das Zytokin Tumornekrosefaktor (TNF)-α eine bedeutende Rolle in der Störung der Insulinsignale zu haben scheint. Gleichzeitig verstärken sich Evidenzen, welche die Rolle des Interleukin (IL)-1β bei der Entstehung von Zellschäden der Beta-Zellen des Pankreas anzeigen.
Mit der Bedeutung von Entzündungsprozessen in der Entstehung von Tumorerkrankungen beschäftigen sich mittlerweile viele spezialisierte Arbeitsgruppen und sogar ein DFG-Sonderforschungsbereich. Bei anderen inflammatorischen Erkrankungen, wie der rheumatoiden Arthritis, ist die Entzündung nicht nur maßgeblich an der Pathogenese beteiligt, sondern bedingt auch kardiovaskuläre Komorbiditäten. Eine Entzündung scheint also ein bedeutender pathophysiologischer Mediator zwischen Grunderkrankung und vergesellschafteten Risikofaktoren bzw. Komorbiditäten zu sein (1, 3, 11).
„Inflammaging“ und „Metaflammation“
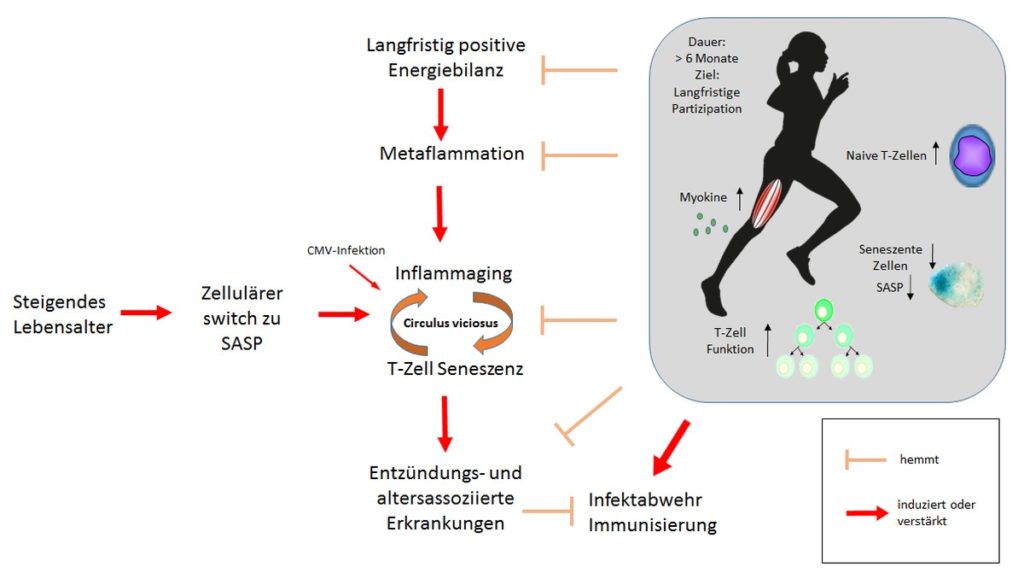
Gleichzeitig geht auch der Alterungsprozess in der zweiten Lebenshälfte mit einer erhöhten systemisch-inflammatorischen Aktivität einher, weshalb der Begriff Inflammaging derzeit häufig in der wissenschaftlichen Literatur gebraucht wird. Inflammaging impliziert, dass sich mit steigendem Lebensalter die basale Aktivität des angeborenen und adaptiven Immunsystems hochreguliert (8). Dabei spielt die Akkumulation seneszenter Zellen eine wichtige Rolle, die erstarrt in einer Phase des Zellzyklus große Mengen inflammatorischer Zytokine bilden. Man spricht von einem zellulären Switch zu einem Senescent-Associated Secretory Phenotype (SASP), welcher derzeit im Fokus altersbedingter Dysfunktionen von Organen und damit als Ursache altersbegleitender Erkrankungen steht (12).
Lebensstilbedingte Risikofaktoren oder Erkrankungen, wie die Adipositas, beschleunigen und verstärken das Inflammaging, da in Adipozyten des viszeralen Fettgewebes stoffwechsel-induzierte Stresssignale ebenfalls Entzündungsprozesse einleiten. Ein solcher metabolisch-induzierter, steriler Entzündungsprozess, der primär seinen Ausgangspunkt in metabolischen Zellen hat, wird als Metaflammation bezeichnet (7, 12).

Nächste Seite: Immunseneszenz und Entzündungen | Klinische Relevanz der Entzündung im Alter
Immunseneszenz und Entzündungen
Die systemischen Entzündungsprozesse haben nicht nur eine enge Assoziation, sondern sind sogar Teil der Alterung des Immunsystems, der Immunseneszenz. Eine Reihe von Untersuchungen in Schweden konnte dazu zeigen, dass die Entwicklung einer systemischen Entzündung eine wichtige Bedeutung im sogenannten Immune-Risk-Profile (IRP) hat (15). Damit werden immunologische Veränderungen im Alter beschrieben, die in Zusammenhang mit einer erhöhten Mortalität und Morbidität stehen. Neben dem moderaten Anstieg pro-inflammatorischer Zytokine im Blut gehören auch eine reduzierte Ratio aus CD4+/CD8+ T-Zellen, eine Akkumulation von T-Zellen eines seneszenten Phänotyps sowie eine Reduktion von naiven T-Zellen zum IRP (15). Die verstärkte Akkumulation seneszenter T-Zellen hat dabei vor allem zwei Charakteristika. Zum einen kann es sich um cytomegalovirus (CMV)-spezifische T-Zellen handeln, insofern der Proband CMV-positiv war. Damit kommt einer CMV Infektion eine nicht unbedeutende Rolle in der Immunseneszenz zu (13).
Zum anderen akkumulieren sogenannte TEMRA Zellen (T effector memory cells re-expressing CD45RA), welche eine hohe Eigenreaktivität haben und pro-inflammatorische Zytokine produzieren, gleichzeitig aber eine geringe Kapazität zur Proliferation im Falle eines Antigenkontaktes haben. Dadurch scheint der Akkumulation von seneszenten, hoch-differenzierten, auch als exhausted T cells bezeichneten Zellen sowohl die Schwächung der Immunabwehr im Alter, als auch das Inflammaging zu begünstigen. Umgekehrt ist bekannt, dass eine basal erhöhte TNF-α Konzentration auch die Differenzierung und damit die Seneszenz von T-Zellen induziert, was die Bidirektionalität dieser Prozesse kennzeichnet (8, 12).
Klinische Relevanz der Entzündung im Alter
Es entsteht also ein Circulus vitiosus aus Entzündung und Immunseneszenz, der letztendlich eine hohe klinische Relevanz hat. Neben der Begünstigung vieler innerer, orthopädischer, neurologischer und psychischer Erkrankungen haben Immunseneszenz und Entzündung zum Beispiel auch Auswirkungen auf die Impfeffektivität. So ist schon länger bekannt, dass die Immunisierung älterer Menschen nach einer Influenza-Impfung oftmals deutlich geringer ausfällt als bei jüngeren Menschen. Eine Bedeutung dabei scheint zusätzlich die Kombination aus Alter und inflammatorischer Grundaktivität zu haben. So zeigen Daten einer jüngeren Veröffentlichung, dass Influenza-Schutzimpfungen in adipösen Erwachsenen einen deutlich reduzierten Schutz bewirken im Vergleich zu Impfungen bei normalgewichtigen, altersgleichen Probanden (9). Trotz einer robusten serologischen Antwort waren die adipösen Studienteilnehmer mehr als doppelt so anfällig für Influenza-Erkrankungen. Vakzinierungsversuche in übergewichtigen Mäusen bestätigen diese Daten, da auch sie einen deutlich verringerten Schutz gegen entsprechende Erkrankungen aufwiesen. Vieles deutet also auf eine enge Verbindung zwischen systemischer Entzündung und zellulärer Seneszenz mit der Folge einer reduzierten Immunfunktion hin (12).
Nächste Seite: Wichtige Ansatzpunkte des Themas Bewegung | Langfristige Strategien in der Umsetzung | Offene Fragen
Wichtige Ansatzpunkte des Themas Bewegung
Diese enge bidirektionale Beziehung zwischen subklinischer Entzündung und zellulärer Immunfunktion geben bewegungspräventiven oder -therapeutischen Maßnahmen zahlreiche interessante Ansatzpunkte. Zum einen hat körperliche Aktivität anti-entzündliche bzw. entzündungsregulierende Effekte, die im Kontext vieler Erkrankungen gezeigt wurden (6). So reduziert regelmäßige körperliche Aktivität die systemische Konzentration von IL-6, TNF-α und zahlreichen anderen Zytokinen und Chemokinen.
Mechanistisch sind dabei vor allem die erhöhte Expression verschiedener Myokine von Bedeutung, die im kontrahierenden Muskel sekretiert werden. Vor allem IL-6 und IL-15 scheinen bedeutsam zu sein, da sie die TNF-α-Produktion hemmen, die Freisetzung anti-entzündlicher Zytokine wie IL-1ra und IL-10 fördern und gleichzeitig die Lipolyse stimulieren (3, 11). Zum anderen hat regelmäßige körperliche Aktivität speziell in Bezug auf T-Zellen vielfältigen Einfluss. Im Alter erhöht regelmäßiges Ausdauertraining die CD4/CD8- T-Zell Ratio und reduziert den Anteil seneszenter T-Zellen. Außerdem erhöht regelmäßiges Training den relativen Anteil regulatorischer T-Zellen (14). Die verstärkte Mobilisation hämatopoetischer Vorläuferzellen aus dem Knochenmark nach sportlichen Belastungen dient möglicherweise einer Erhöhung des Anteils naiver T-Zellen (2,5).
Von funktioneller Seite hat regelmäßige Aktivität positiven Einfluss auf die Proliferation von T-Zellen nach Antigenkontakt. Klinisch relevante Interaktionen zwischen adaptiven Immunsystem und sportlicher Aktivität sind in Bezug einer reduzierte Infekthäufigkeit sowie einer erhöhten Wirksamkeit von Impfungen nach moderaten Ausdauertrainings gezeigt worden (4,10). So zeigten Kohut et al. (4), dass ältere Probanden nach einer Trainingsintervention über 10 Monate einen signifikant höheren Anstieg des Antikörper-Titer nach einer Influenza Vakzinierung im Vergleich zu einer inaktiven Kontrollgruppe hatten.
Langfristige Strategien in der Umsetzung
Durch den Mangel an longitudinalen Interventionsstudien ist bisher noch nicht klar zu definieren, wie die optimale praktische Umsetzung eines auf immunregulatorische Wirkung abgestimmten Trainings aussieht. Die Studienlage zeigt zunächst, dass bedeutende immunologische Effekte mit einer höheren Trainingsdauer einhergehen, in der Regel also länger als länger als 6 Monate Zeit benötigen. Die genaue sportliche Modalität scheint dabei eine geringere Bedeutung zu haben als die gewählten Intensitäten. Hier scheint es ratsam zu sein, dass Patienten mit einer niedrig-gradigen Entzündung eher moderate Intensitäten und Umfänge im Vergleich zu gesunden, jüngeren Personen wählen sollten. Hochgradig-intensive Trainingseinheiten kombiniert mit einer langen Dauer sowie sprunghafte Belastungssteigerungen scheinen aus immunologischer Sicht weniger zielführend, da auch der gesunde Sportler sich hier in eine temporäre Immunsuppression trainiert (14). Die konkrete Wahl einer Sportart sollte Wünsche, Neigungen und Interessen der Zielpersonen berücksichtigen, da dies die Wahrscheinlichkeit einer langfristigen Partizipation erhöht (Abb. 1).
Offene Fragen
Körperliche Aktivität induziert also auf verschiedenen Ebenen immunregulatorische Effekte, bei denen viele mechanistische Zusammenhänge und kausale Interaktionen noch ungeklärt sind. Hier sind vor allem weitere grundlagenwissenschaftlicher Arbeiten notwendig, die molekulare und zelluläre Zusammenhänge zwischen sportlichen Aktivitäten und den verschiedenen Kompartimenten Immunsystem untersuchen. Weiterhin gibt es erst wenige longitudinale Interventionsstudien, die immunologische Veränderungen mit klinischen Effekten koppeln, um Erkenntnisse für die Prävention und Therapie durch Sport und Bewegung er erlangen. Dazu wäre es weiterhin hilfreich, das Panel inflammatorischer Biomarker, wie TNF-α oder IL-6, um weitere Biomarker aus der großen Menge pro- und antientzündlicher Plasmamarker zu erweitern, die sporttherapeutische Effekte möglicherweise sensitiver reflektieren.
■ Krüger K
Ähnliche Beiträge zum Thema finden Sie weiter unten!
Quellen:
Benatti FB, Pedersen BK. Exercise as an anti-inflammatory therapy for rheumatic diseases-myokine regulation. Nat Rev Rheumatol. 2015; 11: 86-97. doi:10.1038/nrrheum.2014.193
Emmons R, Niemiro GM, De Lisio M. Hematopoiesis with Obesity and Exercise: Role of the Bone Marrow Niche. Exerc Immunol Rev. 2017; 23: 82-95.
Karstoft K, Pedersen BK. Exercise and type 2 diabetes: focus on metabolism and inflammation. Immunol Cell Biol. 2016; 94: 146-150. doi:10.1038/icb.2015.101
Kohut ML, Arntson B, Lee W, Rozeboom K, Yoon KJ, Cunnick JE, McElhaney J. Moderate exercise improves antibody response to influenza immunization in older adults. Vaccine. 2004; 22: 2298-2306. doi:10.1016/j.vaccine.2003.11.023
Krüger K, Pilat C, Schild M, Lindner N, Frech T, Muders K, Mooren FC. Progenitor cell mobilization after exercise is related to systemic levels of G-CSF and muscle damage. Scand J Med Sci Sports. 2015; 25: e283-e291. doi:10.1111/sms.12320
Krüger K, Seimetz M, Ringseis R, Wilhelm J, Pichl A, Couturier A, Eder K, Weissmann N, Mooren FC. Exercise training reverses inflammation and muscle wasting after smoke exposure. Am J Physiol Regul Integr Comp Physiol. 2017; [Epub ahead of print]. doi:10.1152/ajpregu.00316.2017
Krüger K. Inflammation during Obesity – Pathophysiological Concepts and Effects of Physical Activity. Dtsch Z Sportmed. 2017; 68: 163-169. doi:10.5960/dzsm.2017.285
Macaulay R, Akbar AN, Henson AM. The role of the T cell in age-related inflammation. Age (Omaha). 2013; 35: 563-572. doi:10.1007/s11357-012-9381-2
Neidich SD, Green WD, Rebeles J, Karlsson EA, Schultz-Cherry S, Noah TL, Chakladar S, Hudgens MG, Weir S, Beck MA. Increased Risk of influenza among vaccinated adults who are obese. Int J Obes. 2017; 41: 1324-1330. doi:10.1038/ijo.2017.131
Nieman DC. Is infection risk linked to exercise workload? Med Sci Sports Ex. 2000; 32: 406-411.
Pedersen BK. Anti-inflammatory effects of exercise: role in diabetes and cardiovascular disease. Eur J Clin Invest. 2017; 47: 600-611. doi:10.1111/eci.12781
Prattichizzoa F, Valeria De Nigris V, Spigab R, Mancusob E, La Salaa L, Antonicellic R, Testad R, Procopioe AD, Olivierie F, Cerielloa A. Inflammageing and metaflammation: The yin and yang of type 2 diabetes. Ageing Res Rev. 2018; 41: 1-17. doi:10.1016/j.arr.2017.10.003
Simpson RJ, Bigley AB, Spielmann G, LaVoy EC, Kunz H, Bollard CM. Human cytomegalovirus infection and the immune response to exercise. Exerc Immunol Rev. 2016; 22: 8-27.
Turner JE. Is immunosenescence influenced by our lifetime ‘‘dose’’ of exercise? Biogerontology. 2016; 17: 581-602. doi:10.1007/s10522-016-9642-z
Wikby A, Mansson IA, Johansson B, Strindhall J, Nilsson SE. The immune risk profile is associated with age and gender: findings from three Swedish population studies of individuals 20–100 years of age. Biogerontology. 2008; 9: 299-308. doi:10.1007/s10522-008-9138-6




