Empfehlungen für Sportler zur Impfung gegen SARS-CoV-2
Ein Überblick zur Studienlage und Empfehlungen zum Vorgehen bei Impfungen gegen SARS-CoV-2 für (Leistungs-)Sportler. Stand: Mai 2021. Dieser Artikel ist Teil unseres Fokusthemas "COVID-19: Infos und Empfehlungen". Den Link zur Übersicht aller Beiträge des Themenschwerpunkts finden Sie am Ende des Textes oder durch Eingabe des Suchbegriffs #Covid-19 in das Suchfeld dieser Website.
Allgemeine Überlegungen zum Impfen von Sportlern
Impfempfehlungen für die Allgemeinbevölkerung (z. B. von der STIKO) können für Sportler, insbesondere für Leistungssportler, nicht ohne Weiteres übernommen werden, weil sich die Abwägungen zwischen Impfrisiken und Immunitätseffekten zum Teil unterscheiden. So können lokale oder systemische unerwünschte Effekte Trainings- und Wettkampffähigkeit von Sportlern beeinträchtigen, während derartige Einschränkungen für andere (berufliche) Aktivitäten nicht zwangsläufig entstehen. Allerdings ist ein resultierender Impfschutz für Sportler etwas wertvoller einzuschätzen, weil ihre Exposition gegenüber einer Impfung zugänglichen Erregern durch sportspezifische enge Kontakte und häufige Reisetätigkeit größer einzuschätzen ist. Nach Abwägung zwischen Vor- und Nachteilen von Impfungen für Sportler empfehlen aktuelle Publikationen eher eine großzügige Indikationsstellung (6, 14). Darunter fallen zum Beispiel die Influenza- und die Hepatitis-A-Impfung, die ansonsten nur für bestimmte Zielgruppen oder Situationen empfohlen werden. Die Autoren stellen aber auch heraus, dass die verfügbare wissenschaftliche Originalliteratur zu Impffragestellungen bei (Leistungs-)Sportlern nur sehr spärlich ist.
Ein zweiter Gesichtspunkt neben der allgemeinen Abwägung zwischen Vorteilen und Risiken einer Impfung besteht für Sportler in der Frage, ob und unter welchen Rahmenbedingungen die aus einer Impfung resultierende Immunität beeinträchtigt sein kann. Eine solche Skepsis beruht auf älteren Befunden, die eine vorübergehend eingeschränkte Immunkompetenz nach akuten Belastungen (sog. “open window”) [9, 10) oder gar eine längerfristige Beeinträchtigung vermuten lassen (sog. “J-shaped curve”) (8). Mittlerweile geht man jedoch davon aus, dass die bisherigen Erkenntnisse nicht ausreichen, um in der Zielgruppe der Leistungssportler eine passagere oder chronische Einschränkung der Immunität durch hohe sportliche Belastungen als gegeben anzusehen (2). So zählen die beim „open window“ beobachteten Veränderungen der Immunfunktion eher zur unspezifischen Abwehr, die nicht zentral in die Entwicklung des Immungedächtnisses involviert ist. Überdies existieren keine Befunde, die konkret auf eine eingeschränkte “Impf-Antwort” hinweisen. Die wenigen unter diesem Aspekt auswertbaren Studien deuten vielmehr eine reguläre bis überdurchschnittliche Immunantwort bei (Leistungs-)Sportlern an (3, 7, 11). Auch auf den negativen Einfluss eines unmittelbar vorangegangenen Trainings deuten aktuelle Ergebnisse nicht hin (13). Unerwünschte Wirkungen traten nicht häufiger auf als bei Kontrollprobanden und waren nicht so ausgeprägt, dass Trainingseinheiten ausfallen mussten (7, 13). Allerdings wurden alle Studien jüngeren Datums mit Totimpfstoffen (Influenza, Hepatitis B) durchgeführt.
Es lässt sich ableiten, dass Impfindikationen bei leistungsorientierten Sportlern eher großzügig gestellt werden sollten und dass wesentliche Einschränkungen durch einen fortlaufenden Trainingsprozess nicht zu erwarten sind. Durch leistungssportliches Training steht weder der Impferfolg in Frage, noch entsteht eine überproportionale Wahrscheinlichkeit für Nebenwirkungen.
Spezifische Überlegungen zur Impfung von Sportlern gegen SARS-CoV-2
Aktuell liegen keine wissenschaftlichen Untersuchungen zu Impfungen gegen SARS-CoV-2 an Sportlern vor, zumal diese zumeist bei einer nationalen Impfpriorisierung nicht an vorderer Stelle stehen. Insofern sind nur Ableitungen aus SARS- CoV-2-Impfungen an anderen Personengruppen möglich oder – mit Vorsicht – solche aus Studien an Sportlern mit anderen Impfstoffarten. Erschwerend kommt hinzu, dass zwei der vier in Deutschland zugelassenen Impfstoffe mRNA-basiert sind (Comirnaty von BionTech-Pfizer und Covid-19 Vaccine Moderna von Moderna) und somit ein neues Konzept des Impfens repräsentieren. Auch für Vektor-basierte Impfstoffe wie die beiden anderen bisher in Europa zugelassenen Impfstoffe (Vaxzevria von AstraZeneca, Covid-19 Vaccine Janssen von Johnson & Johnson), ist die Studienlage schlecht, da es bisher kaum solche Impfstoffe gab.
Wenn entsprechend der Zulassung (Comirnaty 2 mal im Abstand von 3-6 Wochen, Covid-19 Vaccine Moderna 2 x im Abstand von 4-6 Wochen, Vaxzevria im Abstand von 9-12 Wochen; Covid-19 Vaccine Janssen als Einmalimpfung) geimpft wird, ist für beide mRNA-Impfstoffe sowie Vaxzevria eine ähnliche und hohe Effektivität gegenüber schweren Verläufe zu erwarten. Für die Covid-19 Vaccine Janssen liegt der so definierte Impferfolg etwas niedriger, was vermutlich auch daran liegt, dass eine Zulassung schon nach Einmalimpfung angestrebt wurde. Eine Zusammenfassung zu den Impfstoffen findet sich in der Abbildung 1.
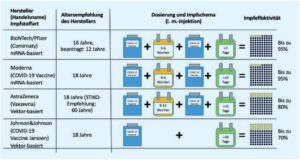
Die Impfstoffe wurden in Zulassungsstudien (1, 5, 12, 15) entweder gegenüber Kochsalz oder gegen eine andere Impfung getestet. Zum einen kam es zu lokalen Nebenwirkungen wie bei jeder Impfung (Schmerzen an der Einstichstelle, Rötung, Schwellung). Zudem waren auch systemische Nebenwirkungen häufig: Abgeschlagenheit, Fieber oder erhöhte Temperatur, Schüttelfrost sowie Kopf- und Gliederschmerzen. Da die Impfstoffe nicht in einer gemeinsamen Studie getestet wurden, lassen sich diese Ergebnisse zwischen den Studien nicht ohne Weiteres vergleichen. Es zeigte sich, dass die Nebenwirkungen nach Impfung mit BionTech nach der 2. Impfung ausgeprägter waren als nach der ersten Impfung; bei AstraZenca war dies umgekehrt.
Unterschiedliche Nebenwirkungsprofile der Impfstoffe sind anhand der Meldedaten des Paul-Ehrlich-Institutes zu erkennen: Während für den mRNA-Impfstoff von BionTech Schmerzen an der Einstichstelle, Kopfschmerzen und vor allem Ermüdung häufig angegeben werden, stehen bei AstraZeneca vor allem Fieber und Schüttelfrost im Vordergrund. Bei Moderna waren Hautauschschläge und Juckreiz besonders häufig. Daten zu Johnson & Johnson existieren in dieser Datenbank nicht, da dieser Impfstoff bisher in Deutschland noch nicht verimpft wurde. Die seltenen Nebenwirkungen wurden in den Medien häufig thematisiert. Aus den Daten des Paul-Ehrlich-Institutes ergibt sich, dass allergische Reaktionen etwa mit einer Häufigkeit von 1:100.000 Impfungen zu erwarten sind bei leicht höheren Werten für die BionTech-Vakzine. Thrombozytopenien (Verringerung der Blutblättchen) und Thrombosen traten bei allen Impfstoffen auf, waren für Vaxzevria von AstraZeneca aber häufiger.
Es ist sinnvoll, aufgrund des Nebenwirkungsprofils nach allen Impfungen für bis zu 2 Tage keine wichtigen Trainingseinheiten, Reisen oder gar Wettkämpfe zu planen und sich nach der Impfung für 30 min in der Arztpraxis/dem Impfzentrum aufzuhalten, um schnell ärztliche Hilfe in Anspruch nehmen zu können, falls es zu allergischen Reaktionen kommt. Die Gabe von Schmerzmitteln ist möglich, wenn dies wegen der Symptome erforderlich ist. Eine prophylaktische Gabe sollte vermieden werden. Als Substanz sollte Paracetamol eingesetzt werden, optimalerweise nicht früher als 6 Stunden nach Impfung, da ggf. sonst die Impftiter niedriger ausfallen könnten (4).
In Fällen in denen bereits eine symptomatische Infektion durchgemacht wurde, wird nur noch eine einzige Impfung empfohlen. Diese sollte frühestens sechs Monate nach der Erkrankung durchgeführt werden, die Impfstoffwahl ist frei. Hintergrund ist die Tatsache, dass man nach einer symptomatischen Erkrankung in der Regel Immunität für mindestens sechs Monate aufbaut und deswegen von einer früheren Impfung keine Vorteile hätte. Anekdotisch wird zudem berichtet, dass die Nebenwirkungen einer solchen Impfung gravierender ausfallen können. Systematische Untersuchungen dazu gibt es aber nicht. Ein weiterer Grund ist die allgemeine Impfstoffknappheit. Aus gesellschaftlicher Perspektive ist es deswegen wichtiger, einer Person eine Erstimpfung zu ermöglichen, die keine Immunität hat.
Blieb eine diagnostizierte SARS-CoV-2-Infektion asymptomatisch und bestehen auch ansonsten keine klinischen Hinweise auf eine wahrscheinlich entstandene Immunität (z. B. durch hohe Antikörpertiter oder sehr niedrige Ct-Werte beim initiatlen Abstrich), ist nach Ablauf von 3-6 Monaten eine komplette Impfung in Erwägung zu ziehen. Dabei ist anhand der individuellen Situation, ggf. auch unter Berücksichtigung von Wettkampfterminen, abzuwägen, ob die dennoch leicht erhöhte Wahrscheinlichkeit von Nebenwirkungen oder die Sicherheit vor einer künftigen Ansteckung Priorität hat. In dieser Situation mag die Einmalimpfung von Johnson & Johnson eine pragmatische Wahl sein.
Die Impfschemata können aktuell auch von den Zulassungsstudien der Impfstoffe abweichen, insbesondere bei Erstimpfung mit dem Impfstoff von AstraZeneca. Dieser Impfstoff ist für Personen unter 60 Jahren als Erstimpfung nicht mehr empfohlen. Wurde bereits eine Erstimpfung mit diesem Impfstoff verabreicht, gibt es die Möglichkeit die Impfserie mit demselben Impfstoff zu beenden oder auf einen anderen Impfstoff auszuweichen. Im Wesentlichen wird unter den gegebenen Umständen der Impfstoff von BionTech infrage kommen. Daten aus Tierversuchen deuten darauf hin, dass sich der Impferfolg dadurch nicht verschlechtert. Zu möglichen Nebenwirkungen lässt sich aus Tierversuchen aber natürlich nichts ableiten. Aufgrund logistischer Probleme besteht nicht in allen Zentren eine Wahlmöglichkeit.
Zusammengefasste Empfehlungen zur Impfung von Sportlern gegen SARS-CoV-2
■ Angesichts der durch die Covid-19-Pandemie hervorgerufenen gesundheitlichen Gefahren und Einschränkungen persönlicher Freiheiten sowie sportlicher Trainings- und Wettkampfmöglichkeiten ist von einer generellen Indikation zur Impfung bei Sportlern – insbesondere Leistungssportlern – auszugehen. Bei Unverträglichkeiten oder spezifischen Kontraindikationen für einzelne Impfstoffe stehen potenziell Alternativen zur Verfügung.
■ Trotz fehlender Datenlage speziell zu SARS-CoV-2 ist grundsätzlich eine gegenüber der vergleichbaren Allgemeinbevölkerung mindestens äquivalente Impfeffektivität zu erwarten.
■ Alle aktuell verfügbaren SARS-CoV-2-Impfstoffe führen eher etwas häufiger und ausgeprägter zu unerwünschten Wirkungen als langjährig etablierte Vakzinen und insbesondere Totimpfstoffe. Dies ist bei der Trainings- und Wettkampfplanung zu berücksichtigen, und die Impftermine sollten nicht unmittelbar vor wichtige Wettkampf- bzw. Trainingstermine gelegt werden. Nach ersten Erfahrungsberichten führt Vaxzevria eher nach der Erstimpfung und die mRNA-Impfstoffe eher nach der Boosterimpfung zu Impfreaktionen.
■ In Fällen mit bereits durchgemachter symptomatischer COVID-19-Erkrankung soll nach 6 Monaten eine einmalige Impfung im Sinne einer Boosterung der Immunantwort durchgeführt werden. Für diese Booster-Immunisierung können alle zugelassenen Impfstoffe verwendet werden. Bei asymptomatischer Erstinfektion sollte eine Impfentscheidung weitere klinische Informationen sowie ggf. zeitliche Wettkampfkonstellationen berücksichtigen. Unter Umständen ist eine „de novo“-Komplettimmunisierung in Betracht zu ziehen.
■ In der Regel kann sich aktuell niemand den Impfstoff aussuchen, mit dem er geimpft werden will. Prinzipiell kann jeder Impfstoff verwendet werden. Die Impfstoffe haben unterschiedliche Effektivität, Nebenwirkungsprofile und Wirkzeitprofile. Insbesondere die Wirkung gegenüber Varianten kann aktuell schlecht abgeschätzt werden, weil ständig neue entstehen (z. B. Indien-Variante). Vorteil von Biontech, Moderna und AstraZeneca ist die höhere Schutzwirkung. Vorteil von Johnson & Johnson ist das einfachere Impfschema und die daraus womöglich resultierende geringe Gesamtdauer eventueller Nebenwirkungen.
■ Covid-19 Vaccine Janssen kommt am ehesten in Betracht, wenn schnell ein Impfschutz aufzubauen ist (z. bei kurzfristiger Anreise zu wichtigen Wettkämpfen) oder eine erforderliche zweite Impfung mit unabwendbaren Erfordernissen (z. B. Abwesenheit wegen längerer Großveranstaltung) kollidiert.
■ Es ist durchaus zu erwarten, dass die Pandemie nicht kurzfristig endet und Virusvarianten sich verändern. Insofern ist damit zu rechnen, dass ähnlich wie bei der Influenza-Impfung künftig Auffrischungen mit leicht veränderten Vakzinen erforderlich sind.
■ Meyer T, Wolfarth B, Gärtner B
Angaben zu finanziellen Interessen und Beziehungen, wie Patente, Honorare oder Unterstützung durch Firmen: Keine
Ähnliche Beiträge zum Thema finden Sie weiter unten!
Alle Beiträge der DZSM zum Fokusthema „COVID-19: Infos und Empfehlungen“ finden Sie hier oder durch Eingabe des Suchbegriffs #Covid-19 in das Suchfeld dieser Website.
Quellen:
BADEN LR, EL SAHLY HM, ESSINK B, KOTLOFF K, FREY S, NOVAK R, DIEMERT D, SPECTOR SA, ROUPHAEL N, CREECH CB, MCGETTIGAN J, KHETAN S, SEGALL N, SOLIS J, BROSZ A, FIERRO C, SCHWARTZ H, NEUZIL K, COREY L, GILBERT P, JANES H, FOLLMANN D, MAROVICH M, MASCOLA J, POLAKOWSKI L, LEDGERWOOD J, GRAHAM BS, BENNETT H, PAJON R, KNIGHTLY C, LEAV B, DENG W, ZHOU H, HAN S, IVARSSON M, MILLER J, ZAKS T; COVE STUDY GROUP. Efficacy and Safety of the mRNA- 1273 SARS-CoV-2 Vaccine. N Engl J Med. 2021; 384: 403-416. doi:10.1056/NEJMoa2035389
CAMPBELL JP, TURNER JE. Debunking the Myth of exercise-induced Immune suppression: Redefining the impact of exercise on immunological health across the lifespan. Front Immunol. 2018; 9: 648. doi:10.3389/fimmu.2018.00648
COTÉ TR, SIVERTSON D, HORAN JM, LINDEGREN ML, DWYER DM. Evaluation of a two-dose measles, mumps, and rubella vaccination schedule in a cohort of college athletes. Public Health Rep. 1993; 108: 431-435.
ETMINAN M, SODHI M, GANJIZADEH-ZAVAREH S. Should Antipyretics Be Used to Relieve Acute Adverse Events Related to Coronavirus Disease 2019 Vaccines? Chest. 2021: S0012-3692(21)00254-3. doi:10.1016/j.chest.2021.01.080
FOLEGATTI PM, EWER KJ, ALEY PK, ANGUS B, BECKER S, BELIJ- RAMMERSTORFER S, BELLAMY D, BIBI S, BITTAYE M, CLUTTERBUCK EA, DOLD C, FAUST SN, FINN A, FLAXMAN AL, HALLIS B, HEATH P, JENKIN D, LAZARUS R, MAKINSON R, MINASSIAN AM, POLLOCK KM, RAMASAMY M, ROBINSON H, SNAPE M, TARRANT R, VOYSEY M, GREEN C, DOUGLAS AD, HILL AVS, LAMBE T, GILBERT SC, POLLARD AJ; OXFORD COVID VACCINE TRIAL GROUP. Safety and immunogenicity of the ChAdOx1 nCoV- 19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet. 2020; 396: 467-478. doi:10.1016/S0140-6736(20)31604-4
GÄRTNER B, MEYER T. Vaccination in elite athletes. Sports Med. 2014; 44: 1361-1376. 10.1007/s40279-014-0217-3doi:
LEDO A, SCHUB D, ZILLER C, ENDERS M, STENGER T, GÄRTNER BC, SCHMIDT T, MEYER T, SESTER M. Elite athletes on regular training show more pronounced induction of vaccine-specific T-cells and antibodies after tetravalent influenza vaccination than controls. Brain Behav Immun. 2020; 83: 135-145. doi:10.1016/j. bbi.2019.09.024
NIEMAN DC. Exercise, infection, and immunity. Int J Sports Med. 1994; 15: S131-S141. doi:10.1055/s-2007-1021128
PEDERSEN BK, BRUUNSGAARD H. How physical exercise influences the establishment of infections. Sports Med. 1995; 19: 393-400. doi:10.2165/00007256-199519060-00003
PYNE DB, GLEESON M. Effects of intensive exercise training on immunity in athletes. Int J Sports Med. 1998; 19(Suppl 3): S183-S194. doi:10.1055/s-2007-971991
ROSIC I, MALICEVIC S, MEDIC S, VLASICH C. Immune response by athletes to hepatitis B vaccination. Vaccine. 2008; 26: 3190-3191. doi:10.1016/j.vaccine.2008.03.051
SADOFF J, GRAY G, VANDEBOSCH A, CÁRDENAS V, SHUKAREV G, GRINSZTEJN B, GOEPFERT PA, TRUYERS C, FENNEMA H, SPIESSENS B, OFFERGELD K, SCHEPER G, TAYLOR KL, ROBB ML, TREANOR J, BAROUCH DH, STODDARD J, RYSER MF, MAROVICH MA, NEUZIL KM, COREY L, CAUWENBERGHS N, TANNER T, HARDT K, RUIZ-GUIÑAZÚ J, LE GARS M, SCHUITEMAKER H, VAN HOOF J, STRUYF F, DOUOGUIH M; ENSEMBLE STUDY GROUP. Safety and Efficacy of Single-Dose Ad26.COV2.S Vaccine against Covid-19. N Engl J Med. In press. doi:10.1056/NEJMoa2101544
STENGER T, LEDO A, ZILLER C, SCHUB D, SCHMIDT T, ENDERS M, GÄRTNER BC, SESTER M, MEYER T. Timing of vaccination after training: immune response and side effects in athletes. Med Sci Sports Exerc. 2020; 52: 1603-1609. doi:10.1249/MSS.0000000000002278
TAFURI S, SINESI D, GALLONE MS. Vaccinations among athletes: evidence and recommendations. Exp Rev Vacc. 2017; 16: 867-869. doi:10.1080/14760584.2017.1358092
VOYSEY M, CLEMENS SAC, MADHI SA, WECKX LY, FOLEGATTI PM, ALEY PK, ANGUS B, BAILLIE VL, BARNABAS SL, BHORAT QE, BIBI S, BRINER C, CICCONI P, COLLINS AM, ET AL.; OXFORD COVID VACCINE TRIAL GROUP. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2021; 397: 99-111. doi:10.1016/S0140-6736(20)32661-1