Die Rolle des Immunsystems bei Muskelverletzungen
Zusammenfassung eines wissenschaftlichen Beitrags (Review) aus der Deutschen Zeitschrift für Sportmedizin (DZSM) mit Link zum englischsprachigen Originalartikel und Downloadmöglichkeit als PDF.
Einleitung
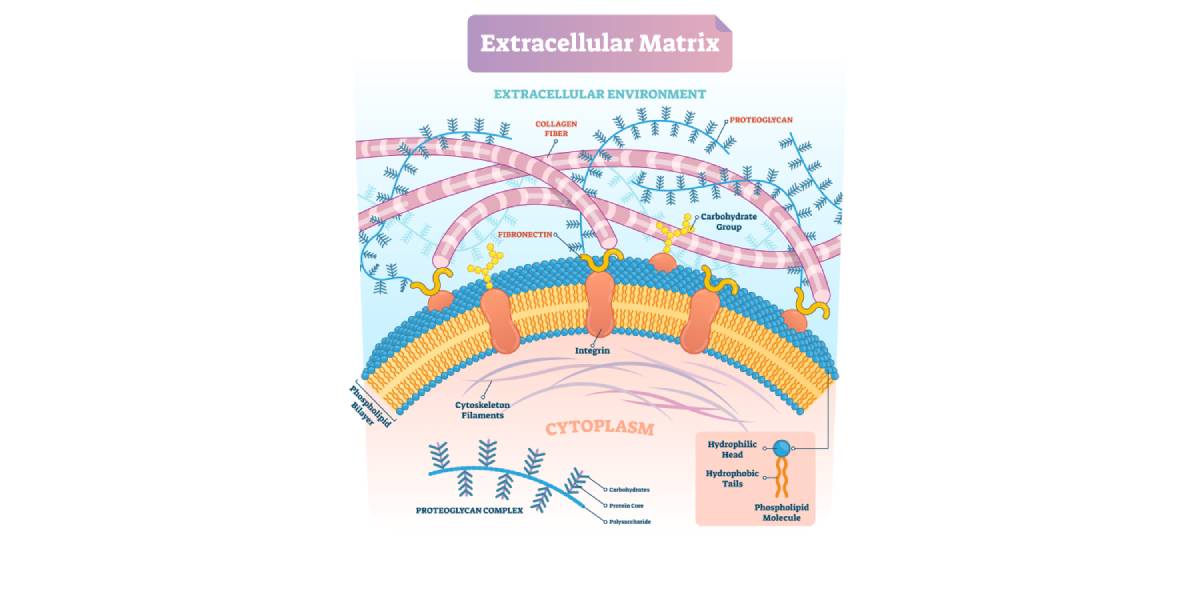
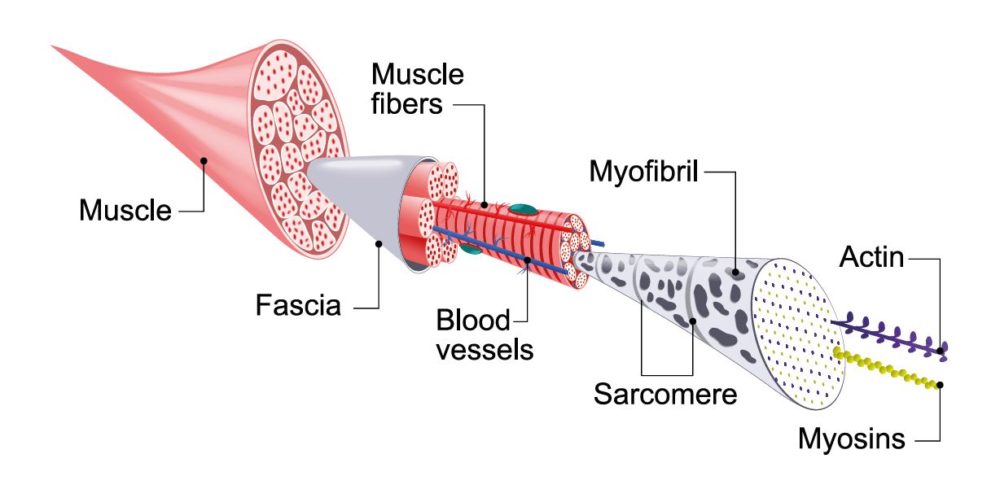
Aufgrund ihrer anatomischen Lokalisation und der Fähigkeit zur explosiv-schnellkräftigen Arbeitsweise, ist die Skelettmuskulatur anfällig für Verletzungen mit unterschiedlichen Schweregraden. Ein funktionales Muskelenvironment erfordert neben der Regeneration myofibrillärer Strukturen jedoch auch die Wiederherstellung der Extrazellularmatrix und von Gefäßen. Akute Muskelverletzungen benötigen im Nachgang daher eine Reihe komplexer molekularer Mechanismen, die die Regeneration des verletzen Gewebes und eine umfassende funktionale Wiederherstellung aller Substrukturen regulieren.
Kernbefunde
Das Immunsystem unterstützt die Skelettmuskelregeneration, indem es die akute Schädigung im Gewebe wahrnimmt und den notwendigen Regenerationsvorgang maßgeblich steuert. Dies geschieht durch zwei zeitlich und funktional unterschiedliche Phasen.
Im ersten, pro-inflammatorischen Abschnitt induzieren Zytokine eine frühe Einwanderung von Makrophagen des Typs M1 in das verletzte Gewebe. Innerhalb der ersten drei Tage bewirken diese Makrophagen einen Abbau von zerstörten Zellstrukturen. Assoziiert mit diesem Zeitfenster ist eine Expression von Zytokinen, die die Proliferation von Satellitenzellen fördern. Eine Änderung des Zytokinprofils zwischen drei und sieben Tagen nach akuter Schädigung initiiert die Typ-2 Immunantwort, die mit einem Anstieg T-regulatorischer Zellen am Ort der Schädigung verbunden ist. Hierdurch wird eine Verschiebung der Makrophagenpopulation in Richtung des pro-regenerativen Typs M2 induziert. Diese initiieren die Produktion von Extrazellularmatrix, hemmen die Proliferation von Satellitenzellen und initiieren die Frühphase der Differenzierung. M2 Makrophagen aktivieren zusätzlich fibro-adipogene Vorläuferzellen (FAP), die zur Matrixsynthese beitragen.
Dieser essentielle Shift des Makrophagenphenotyps wird durch die zunehmende Freisetzung von IL-10 und TGF-β eingeleitet und durch die Aktivierung der AMPK unterstützt. Die durch Makrophagen initiierte, lokale Freisetzung von IGF-1 an den Ort der Schädigung finalisiert das myogene Programm und die Differenzierung der Satellitenzellen. Die hierdurch generierten Myotuben sowie erhöhte Matrixsynthese und Angiogenese gewährleistet letztendlich die Wiederherstellung des funktionalen Environments im Skelettmuskel.
Was ist neu?
– Das Immunsystem nimmt Muskelverletzungen wahr und initiiert eine Kette von molekularen Ereignissen die die Regeneration des Gewebes bis zur vollständigen Ausheilung begleiten
– Zwei unterschiedliche Makrophagentypen induzieren den Abbau von defektem (M1-Makrophagen) und den Wiederaufbau von funktionalem Muskelgewebe (M2-Makrophagen)
– Die pro-inflammatorische Phase aktiviert die Satellitenzellproliferation
– Die anti-inflammatorische Phase aktiviert die Satellitenzelldifferenzierung, Gefäßneubildung und Extrazellularmatrixproduktion
– Gegensätzliche Befunde hinsichtlich der Applikation von nicht-steroidalen, anti-inflammatorischen Medikamenten (NSAID) nach Muskelverletzungen erlauben derzeit keine konkrete Aussage zum generellen Nutzen einer akuten und chronischen Applikation dieser Medikamente.
■ Gehlert S, Jacko D